Los alcoholes son compuestos orgánicos formados a partir de los hidrocarburos mediante la sustitución de uno o más grupos hidroxilo por un número igual de átomos de hidrógeno. El término se hace también extensivo a diversos productos sustituidos que tienen carácter neutro y que contienen uno o más grupos alcoholes.
Usos y aplicaciones
Los alcoholes se utilizan como productos químicos intermedios y disolventes en las industrias de textiles, colorantes, productos químicos, detergentes, perfumes, alimentos, bebidas, cosméticos, pinturas y barnices. Algunos compuestos se utilizan también en la desnaturalización del alcohol, en productos de limpieza, aceites y tintas de secado rápido, anticongelantes, agentes espumígenos y en la flotación de minerales.
El
n-propanol
es un disolvente utilizado en lacas, cosméticos, lociones dentales, tintas de
impresión, lentes de contacto y líquidos de frenos. También sirve como
antiséptico, aromatizante sintético de bebidas no alcohólicas y alimentos,
producto químico intermedio y desinfectante.
El
isopropanol
es otro disolvente industrial importante que se utiliza como anticongelante, en
aceites y tintas de secado rápido, en la desnaturalización de alcoholes y en
perfumes. Se emplea como antiséptico y sustitutivo del alcohol etílico en
cosméticos (p. ej. lociones para la piel, tónicos capilares y alcohol para
fricciones), pero no puede utilizarse en productos farmacéuticos aplicados
internamente. El isopropanol es un ingrediente de jabones líquidos,
limpiacristales, aromatizante sintético de bebidas no alcohólicas y alimentos y
producto químico intermedio.
El
n-butanol
se emplea como disolvente de pinturas, lacas, barnices, resinas naturales y
sintéticas, gomas, aceites vegetales, tintes y alcaloides. Se utiliza como
sustancia intermedia en la fabricación de productos químicos y farmacéuticos, y
en las industrias de cuero artificial, textiles, gafas de seguridad, pastas de
caucho, barnices de laca, impermeables, películas fotográficas y perfumes.
El
sec-butanol
se utiliza también como disolvente y producto químico intermedio, y se
encuentra en líquidos hidráulicos de frenos, limpiadores industriales,
abrillantadores, decapantes de pinturas, agentes de flotación para minerales,
esencias de frutas, perfumes y colorante.
El isobutanol, un disolvente para revestimientos de superficie y adhesivos, se emplea en lacas, decapantes de pinturas, perfumes, productos de limpieza y líquidos hidráulicos.
El
terc-butanol
se utiliza para la eliminación del agua de los productos, como disolvente en la
fabricación de fármacos, perfumes y aromas, y como producto químico intermedio.
También es un ingrediente de productos industriales de alcohol, un
desnaturalizante de alcoholes y un cebador de octano en gasolinas.
Los
alcoholes
amílicos actúan como
espumígenos en la flotación de minerales. Muchos alcoholes, entre ellos el
alcohol metilamílico, 2-etilbutanol, 2-etilhexanol, ciclohexanol, 2-octanol y
metilciclohexanol, se utilizan en la fabricación de lacas. Además de sus
numerosas aplicaciones como disolventes, el ciclohexanol y el metilciclohexanol
son también útiles en la industria textil.
El alcohol bencílico se utiliza en la preparación de perfumes, productos farmacéuticos, cosméticos, colorantes, tintas y ésteres bencílicos. Sirve también como disolvente de lacas, plastificante y desengrasante en productos para la limpieza de alfombras. El 2-cloroetanol se emplea como agente de limpieza y disolvente de éteres de celulos.
El
etanol
es la materia prima de numerosos productos, como acetaldehído, éter etílico y
cloroetano. Se utiliza como anticongelante, aditivo alimentario y medio de
crecimiento de levaduras, en la fabricación de revestimientos de superficie y
en la preparación de mezclas de gasolina y alcohol etílico. La producción de
butadieno a partir de alcohol etílico ha tenido una gran importancia en las
industrias de los plásticos y el caucho sintético. El alcohol etílico puede
disolver muchas sustancias y, por este motivo, se utiliza como disolvente en la
fabricación de fármacos, plásticos, lacas, barnices, plastificantes, perfumes,
cosméticos, aceleradores del caucho, etc.
El metanol es un disolvente de tintas,
colorantes, resinas y adhesivos. Se utiliza en la fabricación de película
fotográfica, plásticos, jabones textiles, tintes de madera, tejidos con capa de
resina sintética, cristal inastillable y productos impermeabilizantes. Sirve
como materia prima para la fabricación de muchos productos químicos y es un
ingrediente de decapantes de pinturas y barnices, productos desengrasantes,
líquidos embalsamadores y mezclas anticongelantes.
Después del cloruro de alilo, el alcohol alílico es el compuestos alílico más importante en la industria. Se utiliza en la fabricación de productos farmacéuticos y en síntesis químicas en general, pero sobre todo para la producción de una serie de ésteres. Los alcoholes se utilizan como productos químicos intermedios y disolventes en las industrias de textiles, colorantes, productos químicos, detergentes, perfumes, alimentos, bebidas, cosméticos, pinturas y barnices. Algunos compuestos se utilizan también en la desnaturalización del alcohol, en productos de limpieza, aceites y tintas de secado rápido, anticongelantes, agentes espumígenos y en la flotación de minerales.
Propiedades
químicas y físicas
- Los
alcoholes son generalmente líquidos e incoloros,
aunque presentan un olor característico. Son solubles en agua mediante puentes
de hidrógeno, aunque solamente en sus versiones más simples, pues a partir del
hexanol empiezan a tener consistencia aceitosa y ser insolubles en agua.
- Similarmente, la densidad de los alcoholes es mayor
conforme al aumento del número de átomos de carbono en
su cadena y las ramificaciones que éstos introduzcan. Lo mismo ocurre con sus
puntos de fusión y ebullición:
aumentan conforme al mayor número de grupos hidroxilo haya en su fórmula,
ya que sus puentes de hidrógeno son difíciles de romper.
- Los alcoholes presentan un carácter dipolar, semejante al del agua, debido a su molécula hidroxilo, lo cual hace de ellos sustancias polares.
- Debido
a ello, pueden comportarse
como ácidos o como bases dependiendo de con qué reactivo se
encuentren. Por ejemplo, si se trata de una base fuerte, el grupo hidroxilo se
desprotona y el oxígeno retiene su carga electromagnética negativa, actuando
como un ácido.
- Por el contrario, si se enfrenta a un ácido muy fuerte, los pares electrónicos del oxígeno hacen que el hidroxilo se protonice, teniendo carga positiva y comportándose como una base débil.
REACCIONES
Reaccionan con los metales
alcalinos como como el Li, Na, K ... y aún con los alcalino-térreos como el Ca.
El hidrógeno del hidroxilo es reemplazado por el metal desprendiéndose en
estado gaseoso.
La acidez de los alcoholes varía ampliamente, desde
los alcoholes que son casi tan ácidos como el agua, hasta algunos que son mucho
menos ácidos. La constante de disociación ácida, Ka, de un alcohol,
queda definida por el equilibrio siguiente:
Los alcoholes son ácidos muy débiles. La constante de acidez (Ka) de la mayoría de los alcoholes se encuentra comprendida entre 10-16 y 10-18.
Esterificación de Fischer
La esterificación de Fischer consiste en tratar un ácido
carboxílico con un alcohol en medio ácido que actúa como agente deshidratante.
Esta reacción puede ser llevada a cabo sin la presencia de un ácido fuerte como
catalizador, pero sucede de manera muy lenta. Generalmente se emplea ácido
sulfúrico como catalizador de la reacción.
![]() El
trióxido de cromo en medio ácido acuoso (reactivo de Jones), el permanganato de
potasio y el dicromato de potasio oxidan lo alcoholes primarios a ácidos
carboxílicos.
El
trióxido de cromo en medio ácido acuoso (reactivo de Jones), el permanganato de
potasio y el dicromato de potasio oxidan lo alcoholes primarios a ácidos
carboxílicos.
Los oxidantes convierten los alcoholes secundarios
en cetonas. No es posible la sobre oxidación a ácido carboxílico.
Deshidrogenación
Los
alcoholes primarios y secundarios cuando se calientan en contacto con ciertos
catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si
esta deshidrogenación se realiza en presencia de aire (O), el hidrógeno sobrante
se combina para dar agua.
Síntesis de alcoholes a partir de halogenuros de alquilo
Los alcoholes se pueden obtener a partir de haloalcanos mediante reacciones SN2 y SN1.
Síntesis de alcoholes mediante SN2
Los haloalcanos primarios reaccionan con hidróxido de sodio para formar alcoholes. Haloalcanos secundarios y terciarios eliminan para formar alquenos.
Síntesis de alcoholes mediante SN1
Los sustratos secundarios y terciarios reaccionan con agua mediante mecanismo SN1 para formar alcoholes.
Hidrólisis de ésteres
Es un método interesante para preparar alcoholes a partir de haloalcanos secundarios. El haloalcano se convierte en éster por reacción con acetato de sodio, para después hidrolizarse en medio ácido o básico, obteniéndose el alcohol.
Reducción de haluros de alcanoilo a alcoholes
Los haluros de alcanoilo se pueden reducir a alcoholes con el hidruro de aluminio y litio (LiAlH4). Si lo que nos interesa es reducirlos a aldehídos es necesario el empleo de un reductor modificado, para evitar la posterior reducción del aldehído formado a alcohol.
Reacciones de reducción.
La hidrogenación de aldehídos y cetonas, que origina alcoholes, es la reacción inversa de la deshidrogenación de éstos para obtener los compuestos carbonílicos citados:
Productos de la síntesis de Grignard
El tipo de alcohol que resulta de una síntesis de Grignard depende del compuesto carbonílico empleado: el formaldehído, HCHO, da alcoholes primarios; otros aldehídos, RCHO, dan alcoholes secundarios, y las cetonas, R2CO, dan alcoholes terciarios.
La reacción de ésteres carboxílicos con compuestos de Grignard es un método excelente para preparar alcoholes terciarios. Al igual que con aldehídos y cetonas, el grupo alquilo o arilo nucleofílico (básico) del reactivo de Grignard se une al carbono carbonílico deficiente en electrones. La expulsión del alcóxido generaría una cetona, que en casos especiales puede aislarse efectivamente. Sin embargo, sabemos que las cetonas reaccionan fácilmente con compuestos de Grignard para generar alcoholes terciarios. En el caso expuesto, se obtienen productos que corresponden a la adición del reactivo de Grignard a dicha cetona:
Hidratación de alquenos
Al tratar el tema de los alquenos vimos que se pueden obtener alcoholes por hidratación de los mismos, teniendo en cuenta que por este procedimiento se obtienen alcoholes de acuerdo con la regla de Markovnikov.
El agua es un ácido muy débil, con una concentración de protones insuficiente para iniciar la reacción de adición electrófila. Es necesario añadir al medio un ácido (H2SO4) para que la reacción tenga lugar.
El mecanismo transcurre con formación de un carbocatión previa adición del protón al doble enlace. La hidratación de alquenos es Markovnikov, es decir, el protón se adiciona al carbono menos sustituido del alqueno (carbono con más hidrógenos).
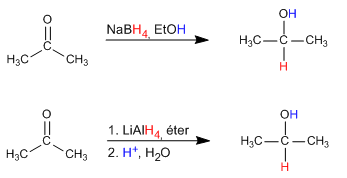
Reducción de compuestos carbonílicos
Para la reducción de los compuestos carbonílicos se suelen emplear hidruros como el NaBH4 que es muy selectivo y no reduce el ácido y ésteres o el LiAlH4 que es un reactivo más enérgico y reduce también los ácidos, ésteres y otros derivados de ácido.
Normalmente los aldehídos se reducen a alcoholes primarios y las cetonas a alcoholes secundarios. Los ácidos y ésteres se reducen a alcoholes primarios.
Referencias
Referencias
Enciclopedia de Salud y seguridad del Trabajo. (2020). Propiedades
de los alcoholes . Obtenido de insst.es:https://www.insst.es/documents/94886/162038/2.+Alcoholes+-+Aldeh%C3%ADdos+y+cetales+-+Materiales+alcalinos
Gauman, N., &
Pilco, C. (2013). Alcoholes. Obtenido de Slideshare.net:
https://es.slideshare.net/paulaguila/exposiciones-de-alcoholes
McMurry, J. (2008). Química
Orgánica ( Séptima ed.). México: Cengage Learning.
Raffino, M. E. (2020). Alcoholes. Obtenido de Concepto.de: https://concepto.de/alcoholes/













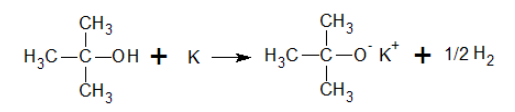





















No hay comentarios.:
Publicar un comentario