Las aminas son compuestos y grupos funcionales que se derivan del amoniaco (NH3), un gas que se compone de tres átomos de hidrogeno y uno de nitrógeno. El nitrógeno forma tres enlaces simples a través de los orbitales con hibridación sp3. El par solitario ocupa el cuarto orbital con hibridación sp3 y es el responsable del comportamiento básico y nucleófilo de las aminas.
Usos y aplicaciones de las aminas
Colorantes: Las aminas aromáticas primarias pueden servir como material de partida para las síntesis de colorantes azo. Inicialmente, las aminas reaccionan para formar sales de diazonio, las cuales forman los compuestos azo mediante copulación azoica. Dado a la intensa coloración que poseen, son usados en la industria textil como material de teñido. Algunos ejemplos son: Anaranjado de metilo, marrón 138 directo, amarillo atardecer FCF y ponceau.
Farmacos y drogas: Muchos medicamentos actúan con agonistas y antagonistas de los neurotransmisores amínicos naturales, entre ellos se pueden encontrar:
- La clorofeniramina: Es un antihistamínico usado en el control de los procesos alérgicos, los cuales se producen por la ingesta de algunos alimentos, la fiebre del heno, la picadura de insectos, etc.
- La clorpromazina: Es un agente sedante, no inductor del sueño, que alivia la ansiedad e inclusive se usa en el tratamiento de algunos trastornos mentales.
- La efedrina y la fenilefedrina: Se utilizan como descongestionantes de las vías respiratorias.
- La amitriptalina y la imipramina: Son aminas terciarias que se utilizan en el tratamiento de la depresión, debido a su estructura se clasifican cono antidepresivos tricíclicos.
- Los analgésicos opiáceos como la morfina, la codelina y la heroína son aminas terciarias.
Tratamiento de gases: Varias aminas, entre ellas la diglicolamina (DGA) y la dietanolamina (DEA), son empleadas en la eliminación de los gases dióxido de carbono (CO2) y el sulfuro de hidrógeno (H2S) presentes en el gas natural y en las refinerías.
Química agricola: Las metilaminas son compuestos intermediarios en la síntesis de productos químicos que se utilizan en la agricultura como herbicidas, fungicidas, insecticidas, y biocidas.
Manufactura de resinas: Las metilaminas se emplean durante la elaboración de resinas de intercambio iónico, utilizables en la desionización del agua.
Nutrientes de animales: La trimetilamina (TMA) es usada primordialmente en la producción de cloruro de colina, un suplemento de la vitamina B usado en la alimentación de pollos, pavos y cerdos.
Industria del caucho: El oleato de dimetilamina es un emulsionante para uso en la producción de caucho sintético, se usa directamente como un modificador de la polimerización en la fase de vapor del butadieno y como estabilizador del látex del caucho natural en lugar del amoníaco.
Solventes: La dimetilamina (DMA) y la monometilamina (MMA) son utilizadas para sintetizar los disolventes polares apróticos como la dimetilformamida (DMF), dimetilacetamida (DMAc) y n-metilpirrolidona (NMP). Entre las aplicaciones de la dimetilformamida, se incluyen: recubrimiento de uretano, disolvente de hilados de acrílicos, solventes de reacción y solventes de extracción; mientras que la dimetilacetamida se emplea en la fabricación de colorantes y disolvente de hilados. Por último, la n-metilpirrolidona se utiliza en la refinación de aceites lubricantes, decapante de pinturas y recubrimiento de esmaltes.
Neurotransmisores: Como es el caso de la dopamina, la cual se encuentra distribuida en el sistema nervioso y dependiendo de la ubicacion ejerce diversas funciones relacionadas con el placer, la motivación, la coordinación de movimientos, la toma de decisiones, el aprendizaje, etc.
Aminoácidos: Los aminoacidos son las unidades constituyentes de las proteínas, están compuestos de un grupo carboxilo (-COOH) y un grupo amino (-NH2). Existen 20 aminoácidos comprendidos en esenciales y no esenciales; son esenciales cuando el organismo no los sintetiza y es necesario ingerirlos en los alimentos, mientras que los no esenciales son aquellos que el organismo si los puede sintetizar.
Vitaminas: Son compuestos orgánicos que necesarios para el organismo, pero que no pueden ser fabricados por el mismo; sirven principalmente como catalizadores de ciertas reacciones en el cuerpo. Si se produce una deficiencia de vitaminas, las funciones normales del cuerpo pueden verse afectadas. Las vitaminas se obtienen de los alimentos, pero hay excepciones, como la vitamina K, se produce en ciertas bacterias de los intestinos y la vitamina D que se produce con la ayuda de la radiación ultravioleta sobre la piel. Anteriormente, se pensaba que las vitaminas eran todas las aminas que esenciales para la vida, pero no todas las vitaminas son aminas, sin embargo se mantuvo el término vit-aminas para estos suplementos nutricionales.
Olores de las aminas: Las aminas son compuestos básicos con olores fuertes. El olor de las aminas se suele describir como "olor a pescado", ya que el olor del pescado crudo proviene de las aminas que contienen. Incluso el término "mal olor", se destaca por 2 aminas de las aminas producidas en la carne en descomposición cuyos nombres son la cadaverina y putresina.
Reacciones quimicas de las aminas
Basicidad de aminas: Una amina es un nucleofilo (una base de Lewis) dado a que el par solitario de electrones no enlazantes pueden formar un enlace con un electrófilo.Una amina también puede actuar como una base de Bronsted- lowry, aceptando un protón de un acido.
Alquilación de las aminas:
Mecanismo de reducción de amidas:
Reducción de nitro compuestos (-NO2): Los grupos (-NO2) se reducen a (-NH2) por hidrogenación catalítica, metal actico con acido. Se utiliza normalmente para sintetizar anilinas.
Ejemplo:
Reducción de nitrilos: Los nitrilos se pueden preparar por reacción de haloalcanos con cianuro de sodio. La reducción de nitrilos con LiAlH4 produce aminas.
Etapa 1: Obtención de nitrilo a partir de haloalcanos primarios o secundarios.
Etapa 2: Reducción del nitrilo a amina.
Ejemplo:
Hidrolisis de aminas: Las amidas se transforman en aminas y ácidos carboxílicos por tratamiento con soda acuosa bajo calefacción.
Etapa 1: Ataque nucleófilo.
Etapa 2: Eliminación.
Etapa 3: Equilibrio ácido-base desplazado.
Degradación de Hoffman: La eliminación de Hoffman permite convertir aminas en alquenos. Es una reacción regio selectiva que sigue la regla de Hoffman, formando el alqueno menos sustituido mayoritariamente.
Etapa 1: Metilación exhaustiva de la amina. En esta etapa se hace reaccionar la amina con exceso de yoduro de metilo, para formar una sal de amonio.
Etapa 2: Tratamiento con óxido de plata acuoso. Sal básica que forma un hidróxido de amonio, precipitando el yoduro en forma de yoduro de plata.
Etapa 3: Eliminación biomolecular. El hidróxido de amonio sufre una E2 al calentar, que da lugar al alqueno.
Acilación: Un cloruro de ácido reacciona con amoniaco o con una amina primaria o con una amina secundaria para formar una amida.
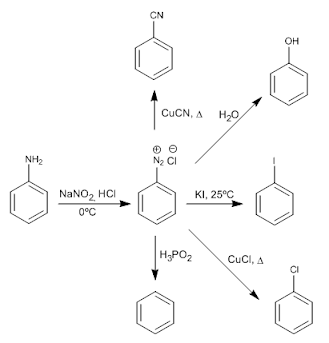
Reacción con ácido nitroso: El nitrito de sodio en medio ácido acuso produce cationes nitrosilo (NO+) que son atacados por las aminas formando sales de nitrosamonio.
Generación del catión (NO+): El nitrito de sodio en presencia de ácido clorhídrico genera ácido nitroso que por pérdida de una molécula de agua produce cationes (NO+).
Reacción con aminas primarias: Las aminas primarias reaccionan con los cationes (NO+) formados en el medio de reacción dando lugar a sales de diazonio que evolucionan hacia mezcla de productos haloalcanos, alcoholes, alquenos.
Etapa 1: Ataque nucleófilo al catión (NO+).
Etapa 2: Equilibrio ácido-base.
Etapa 3: Equilibrio ácido-base.
Etapa 4: Perdida de agua para formar la sal de diazonio.
Etapa 5: Descomposición de la sal de diazionio.
Reacción de aminas secundarias: Las aminas secundarias atacan al catión (NO+) formado en el medio de reacción para formar nitrosaminas estables.
Reacción de Sandmeyer: En este reacción se reemplaza el grupo diazonio por los grupos halogeno (F,Cl, Br y I) y el grupos ciano(-CN).
Reacción de acoplamiento diazoico: Se produce esta reacción entre una sal de diazonio y un compuesto aromático activado.
Referencias
Baxter, S. (2017). Vitaminas . Obtenido de HyperPhysics.edu: http://hyperphysics.phy-astr.gsu.edu/hbasees/Organic/vitamin.html
Blesa, M. J. (2010). Tema 17: Aminas reacciones. Obtenido de Unizar.es: https://ocw.unizar.es/ensenanzas-tecnicas/quimica-organica-para-ingenieros/temas/Tema17.Aminas.pdf
Bolivar, G. (2019). Aminas: estructura, propiedades, tipos, usos, ejemplos. Obtenido de Lifeder.com: https://www.lifeder.com/aminas/
Ingeniograma enciclopedico. (16 de Abril de 2010). Que es una amina y cuales son los aminoacidos. Obtenido de Ingeniograma-enciclopedico fandom.com: https://ingeniograma-enciclopedico.fandom.com/es/wiki/Que_es_una_amina_y_cuales_son_los_aminoacidos
Nave, O. (2017). Aminas . Obtenido de HyperPhysics.edu: http://hyperphysics.phy-astr.gsu.edu/hbasees/Organic/amine.html
























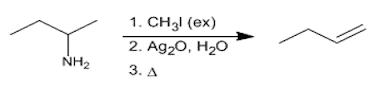
















No hay comentarios.:
Publicar un comentario