Reconocidas como compuestos polares, las cetonas
suelen ser solubles y volátiles, lo que las hace buenos solventes y aditivos
para los perfumes. Además, son fáciles de preparar, relativamente estables y
poseen una alta reactividad, lo que las ha convertido en un compuesto
intermedio casi perfecto para preparar compuestos orgánicos más complejos.
USOS Y APLICACIONES DE LA CETONA
Metil-etil-cetona: El principal uso de la metiletilcetona (MEK) es en la
aplicación de adhesivos y revestimientos protectores, lo que refleja sus
excelentes características como disolvente. Se utiliza también como disolvente
en la producción de cintas magnéticas, el desparafinado de aceites lubricantes
y el procesamiento de alimentos. Es un componente habitual de barnices y colas,
así como de muchas mezclas de disolventes orgánicos.
Acetona: Conocida también como propanona, es un compuesto incoloro
utilizado para la fabricación de diversos productos industriales como los
plásticos, así como para productos de higiene del hogar y cosméticos como el
quitaesmalte. También, Utilizado para la fabricación de
metil metacrilato de metilo, ácido metacrílico, metacrilatos, bisfenol A, entre
otros. Distribución del acetileno en cilindros y la nitroglicerina. Limpieza de
microcircuitos, partes electrónicas, etc. Limpieza de prendas de lana y pieles.
Cristalización y lavado de fármacos. Como base para diluyentes de lacas,
pinturas, tintas, etc. En la vida doméstica, es el disolvente por excelencia
para las pinturas de uñas y una mezcla de ambas se usa como disolvente-cemento
de los tubos de PVC.
Ciclopentanona: se utilizan como disolvente y en gran medida para la
obtención de la caprolactama, un monómero en la fabricación del Nylon 6 y
también por oxidación del ácido adípico que se emplea para fabricar el Nylon
66.
Butano-2,3-diona: es un ingrediente
fundamental del aroma de la margarina.
Metadona: Este psicofármaco empezó a utilizarse como sedante y como remedio contra la tos, sin mucho éxito. Actualmente se emplea en los programas de desintoxicación y mantenimiento de los farmacodependientes de opiáceos, tales como la heroína.
Alcanfor: es una cetona que se encuentra en forma natural y se
obtiene de la corteza del árbol del mismo nombre. Tiene un olor fragante y
penetrante; conocido desde hace mucho tiempo por sus propiedades medicinales,
es un analgésico muy usado en linimentos. Otras dos cetonas naturales,
beta-ionona y muscona, se utilizan en perfumería. La beta ionona es la esencia
de violetas.
La muscona, obtenida de las de las glándulas odoríferas del venado almizclero macho,
posee una estructura de anillo con 15 carbonos.
Butanona: Conocido también como MEK (o MEC), este líquido es producido en gran escala en la industria y es utilizado como solvente.
Ciclohexanona: Producida a enorme escala, esta cetona se usa como precursora del material sintético nylon.
- Pinturas y recubrimientos: se
usa como disolvente de resinas sintéticas, polímeros, lacas y
tintes.
- Industria textil: Se usa para
la producción de caprolactama usada en la fabricación de nylon 6.
- Curtidurías: Desengrasante
par cuerpo.
- Plásticos: Sellado
de PVC
- Agricultura: en herbicidas.
- Solvente.
Testosterona: Es la hormona principal del sexo masculino y un esteroide
anabólico, encontrado en la mayoría de los vertebrados.
Progesterona: Esteroide endógeno y hormona sexual involucrada en el ciclo menstrual, embarazo y embriogénesis en los seres humanos y otras especies.

Cortisona: Hormona esteroide utilizada para combatir ciertas dolencias y afecciones como inflamaciones, acné, alergias y otro tipos de reacciones cutáneas, asma o cáncer y leucemia.
La función de la cortisona suele ser
suprimir el sistema inmunitario, para reducir la respuesta inflamatoria y
neutralizar el dolor y la hinchazón. No obstante, No obstante, hay que tener
mucho cuidado con los efectos secundarios que puede tener.
Benzofenona: Compuesto muy utilizado en la creación de perfumes y
demás productos cosméticos o de protección solar debido su composición
aromática.
Propiedades químicas de las cetonas
Las cetonas, como la
mayoría de los aldehídos, son moléculas líquidas y presentan una serie de
propiedades físicas y químicas que varían dependiendo de la longitud de sus
cadenas.
Las cetonas se comportan como ácidos debido a la presencia del grupo carbonilo,
esto hace que presenten reacciones típicas de adición nucleofílica.
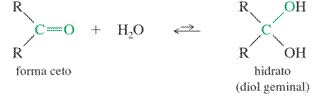
Hidratación de cetonas
Cetonas
reaccionan en medio ácido acuoso para formar hidratos. El mecanismo consta de
tres etapas. La primera y más rápida consiste en la protonación del oxígeno
carbonílico. Esta protonación produce un aumento de la polaridad sobre el
carbono y favorece el ataque del nucleófilo. En la segunda etapa el agua ataca
al carbono carbonilo, es la etapa lenta del mecanismo. En la tercera etapa se
produce la desprotonación del oxígeno formándose el hidrato final.
Adición de amoniaco y sus derivados
Las cetonas reaccionan con el amoniaco NH3, o con las aminas para formar un grupo de sustancias llamadas iminas o bases de Schiff. Las iminas resultantes son inestables y continúan reaccionando para formar, eventualmente, estructuras más complejas.
Adición del reactivo de Grignard
Al reaccionar con un compuesto de Grignard, el metanal da lugar a la formación de alcoholes primarios; los otros aldehídos producen alcoholes secundarios; y las cetonas, alcoholes terciarios. En todas estas adiciones, el grupo Mg.-halógeno (reactivo electrofílico) se adicionan al oxígeno negativo y el radical alquilo, al carbono del grupo carbonílico.
Al adicionar alcoholes a las cetonas se producen
hemicetales. Esta reacción con alcohol es de tipo reversible con un catalizador
ácido para producir cetales. Como el
agua, los alcoholes son nucleofílicos débiles que se unen lentamente a las
cetonas en condiciones neutras. En condiciones ácidas el oxígeno del carbonilo
se protona, siendo así mas reactivo que el neutro.
Reacción
de halogenación de las cetonas: Cuando se hace reaccionar una cetona con halógeno en medio ácido o básico se
procede a la halogenación en el carbono a. Se da
la Halogenación cuando una cetona está en presencia de una base fuerte. La reacción
de sustitución ocurre en el carbono contiguo al grupo funcional. No obstante,
puede reaccionar más de un halógeno, sustituyendo los hidrógenos pertenecientes
a la cadena.
Oxidación de Baeyer Villiger
El mecanismo de esta reacción consiste en el ataque del
oxígeno (rojo) del peroxiácido al carbono carbonilo de aldehídos o cetonas. El
aducto formado es inestable y se descompone, produciéndose la migración de un
grupo alquilo del carbono carbonilo al oxígeno, para dar un éster.
Las cetonas se oxidan con perácidos
Los ácidos peroxicarboxílicos también se adicionan
sobre el grupo carbonilo de aldehídos y cetonas, produciendo ésteres mediante
una transposición.
Baeyer Villiger con cetonas cíclicas
Las cetonas cíclicas generan ésteres cíclicos. Las
cetonas asimétricas conducen a dos ésteres distintos ya que los sustituyentes
no tienen la misma aptitud migratoria.
Formación de encaminas:
Como vimos en apartados anteriores la condensación de aminas primarias con aldehídos y cetonas generan iminas. En este apartado estudiaremos la condensación de carbonilos con aminas secundarias que dan enaminas.
Los impedimentos estéricos hacen que las enaminas
menos sustituidas sean las más estables.
Hidratación de alquinos
En presencia de sulfato mercúrico y ácido sulfúrico diluido, como catalizadores, se adiciona una molécula de agua al triple enlace de un alquino, con lo que se forma primero un enol que, al ser inestable, se isomeriza por reagrupamiento en un compuesto carbonílico.
Oxidación de alquenos
El resultado global de la ozonólisis es la ruptura del doble enlace
carbono-carbono de la molécula, el oxígeno se une a cada uno de los dos átomos
que forman el doble enlace original formando aldehídos o cetonas.
Oxidación de alcoholes
Los alcoholes primarios y secundarios se oxidan
para dar aldehídos y cetonas respectivamente. Deben tomarse precauciones en la
oxidación de alcoholes primarios, puesto que sobreoxidan a ácidos carboxílicos
en presencia de oxidantes que contengan agua. En este caso debe trabajarse con
reactivos anhídros, como el clorocromato de piridino en diclorometano (PCC), a
temperatura ambiente.
La oxidación de alcoholes secundarios produce cetonas, este proceso implica la deshidrogenación del alcohol.
La oxidación supone la pérdida de dos hidrógenos del
alcohol. Los alcoholes terciarios no pueden oxidar puesto que carecen de
hidrógeno sobre el carbono.
Acilación de Friedel-Crafts: La
introducción de grupos acilo en el benceno permite la preparación de cetonas con
cadenas aromáticas.
Referencias
Flores, A. A. (2018). Usos y Aplicaciones de
Aldehídos y Cetonas. Obtenido de Wordpress.com:
https://miseptiembrerojo.wordpress.com/2018/12/18/usos-y-aplicaciones-de-aldehidos-y-cetonas/#:~:text=Son%20intermediarios%20en%20la%20s%C3%ADntesis,%3B%20herbicida%2C%20fungicida%20y%20pesticida.
González, A. O. (5 de
Abril de 2016). Aldehídos y Cetonas. Obtenido de Blogspot.com:
http://astridolveragonzalez.blogspot.com/2016/04/aldehidos-y-cetonas.html
Idict, C. (31 de Julio
de 2019). Cetonas. Obtenido de Ecured.cu:
https://www.ecured.cu/Cetonas
McMurry, J. (2008). Química
orgánica (7a ed.). México D.F: Cengage Learning.
McMurry, J. (2012). Química
orgánica (8a ed.). México D.F: Cengage Learning.
Muhye, A. (2019). Cetonas:
tipos, propiedades, nomenclatura, usos. Obtenido de Lifeder.com:
https://www.lifeder.com/cetonas/
































No hay comentarios.:
Publicar un comentario